ELEMENTI – Centodiciotto, viale dei Gas Nobili, 118
Finora sono stati sintetizzati soltanto tre atomi di 118. La ricerca degli elementi transuranici è concentrata praticamente in due laboratori nel mondo, uno negli Stati Uniti a Berkeley, in California e uno a Dubna, in Russia
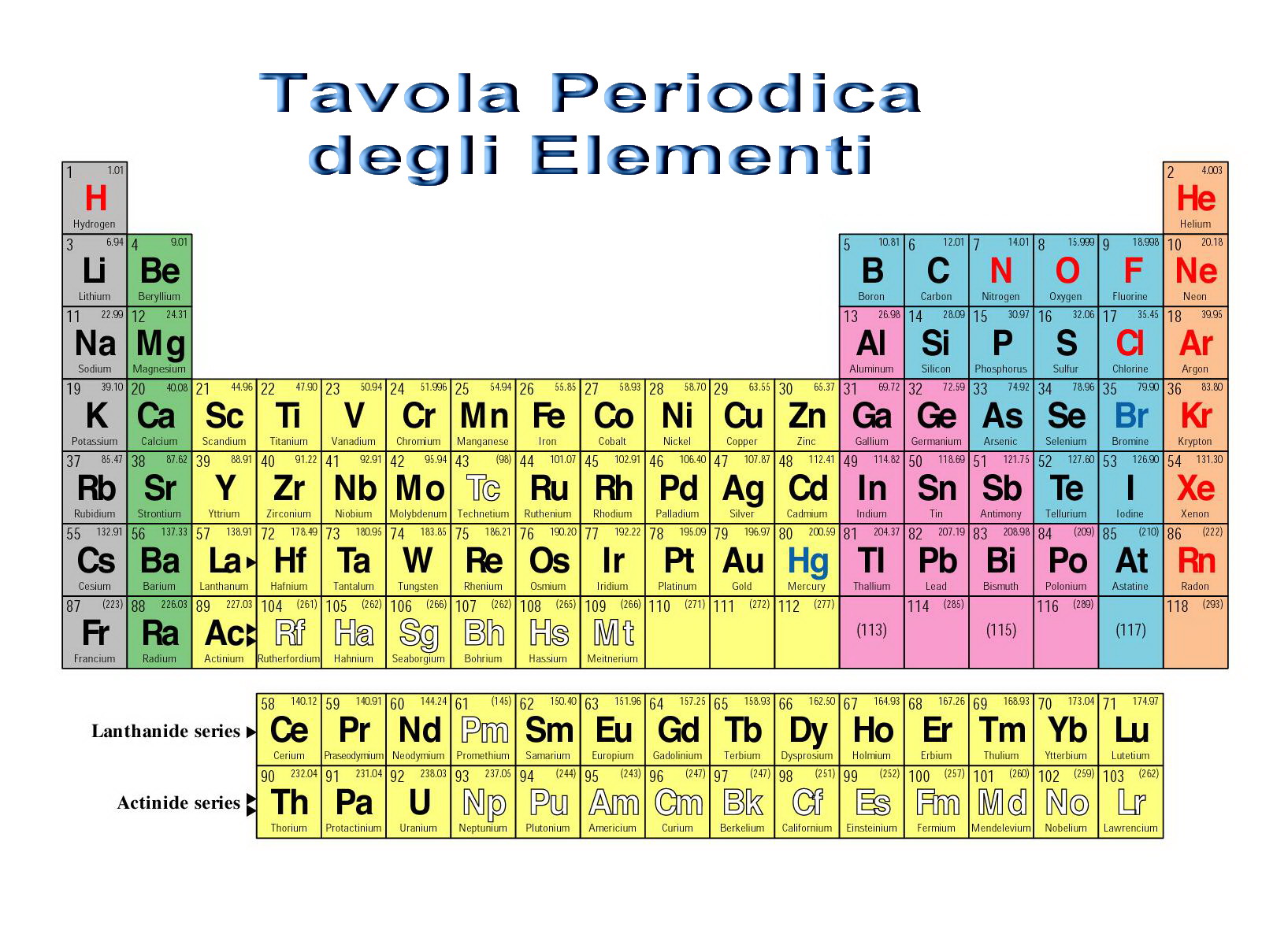
Chiudo la serie degli elementi di questo Anno Internazionale della Chimica con l’elemento 118, provvisoriamente denominato Uuo, cioè Un-un-oczio l’ultimo scoperto proprio di recente: Il 118 (lo chiamo così confidenzialmente) ha peso atomico 294; è costituito, cioè, da 118 protoni e 176 neutroni. La sua posizione dovrebbe essere nella colonna dei gas nobili, sotto il radon. Uso il termine dubitativo perché finora ne sono stati sintetizzati soltanto tre atomi ottenuti bombardando il californio-249 e il curio-245 con calcio-48.
La ricerca degli elementi transuranici è concentrata praticamente in due laboratori nel mondo, uno negli Stati Uniti a Berkeley in California e uno a Dubna, in Russia. Due gruppi di studiosi in gara fra loro nella “fabbricazione” di elementi sempre più grossi, finora sconosciuti in natura, utilizzando dei grandi acceleratori di particelle e di nuclei. Pensate che negli Stati Uniti ci sono volute oltre mille ore di bombardamento per creare i tre atomi di Centodiciotto, difficili da identificare perché decadono in appena 0,9 millisecondi, con formazione dell’elemento Centosedici con numero atomico 116 e peso atomico 293.
Serve a qualcosa spendere tanti soldi in esperimenti che forniscono risultati così volatili? Io dico di si e credo che Mendeleev sarebbe contento, là dove si trova, a vedere un allungamento della sua tabella. I fisici teorici ritengono che, passata una lunga serie di elementi radioattivi che decadono rapidamente, si dovrebbe arrivare ad un gruppo di elementi abbastanza stabili. La chiamano l’isola della stabilità, una idea proposta dal fisico americano, Premio Nobel, Glenn Seaborg (1912-1999) mezzo secolo fa, ma ancora difficile da verificare sperimentalmente.
Tale “isola” dovrebbe comprendere elementi aventi numero atomico fra 114 e 126 e peso atomico fra 298 e 310. La loro produzione richiede la combinazione di elementi con il numero “giusto” di protoni e neutroni, ma quelli adatti sono instabili ed è quindi difficile farli scontrare negli acceleratori anche più potenti.
Non so cosa pensiate, ma, come chimico, sono orgoglioso di appartenere ad una genìa che ha la possibilità di affacciarsi su mondi sconosciuti non di fantascienza, ma reali; così come Mendeleev 150 anni fa ha visto arrivare a poco a poco tutti gli atomi che aveva previsto e che non conosceva, come Marie Curie, cento anni fa, ha visto materializzarsi i raggi misteriosi in sostanze che si potevano pesare: forse qualche lettore chimico vedrà realizzati elementi oggi impensabili. A tale lettore del futuro e a tutti i lettori che hanno avuto la pazienza di leggere, settimana dopo settimana, le schede di questa rubrica auguro, insieme alla redazione, un felice anno 2012.
Giorgio Nebbia
Contenuti correlati
-
Partnership Simplifhy – Itsgreen per realizzare un laboratorio a idrogeno per la ricerca
Simplifhy e la Fondazione Itsgreen hanno firmato un accordo per l’istituzione di un avanzato laboratorio a idrogeno. Il laboratorio, situato nella sede di Itsgreen a Vimercate (MB), offre agli studenti dell’istituto un’opportunità unica per immergersi nella ricerca,...
-
Allarme rendicontazione ESG nei bilanci delle aziende europee
Le imprese europee corrono il rischio di essere percepite dai cittadini come poco trasparenti rispetto al loro reale impegno in tema di sostenibilità. Sono ben 7 su 10 (70%) le aziende del Vecchio Continente che pubblicano bilanci...
-
COP27 e Agenda 2030: i grandi del pianeta per lo sviluppo sostenibile
Si è da poco conclusa Cop27, la conferenza delle Nazioni Unite sui cambiamenti climatici. Focus principale dell’incontro è stato l’urgenza di un’azione immediata in materia ambientale, consci del fatto che il delicato contesto geopolitico in Ucraina ha...
-
Carrier investe in Italia 14 milioni di euro per la realizzazione di un nuovo Centro di Ricerca e Sviluppo di Eccellenza
Carrier annuncia un investimento di 14 milioni di euro per costruire un nuovo Centro di Eccellenza di R&S per il riscaldamento, il condizionamento e i sistemi di acqua sanitaria a Villasanta, Monza (MB). La struttura si concentrerà...
-
17 giugno, Giornata Mondiale per la lotta alla Desertificazione e alla Siccità
La siccità è realtà ed è un problema attuale e globale, che riguarda tutti e che va oltre specifiche zone, superando i confini regionali. In Italia la fotografia è allarmante, con oltre il 20% del territorio nazionale...
-
5 giugno: World Environment Day
In occasione della Giornata Mondiale dedicata al benessere dell’ambiente, emergono dati preoccupanti in merito alle produzioni industriali globali. Le soluzioni per invertire il trend? Innumerevoli, a partire da sistemi innovativi per il risparmio dell’acqua al riutilizzo degli...
-
Ricerca applicata alle imprese: approvati i progetti all’avanguardia di SENEC, Unisalento e CNR Nanotec
SENEC, azienda nota a livello internazionale nel settore dell’autosufficienza energetica, insieme all’Università del Salento ed al CNR Nanotec di Lecce, si è aggiudicata due progetti nell’ambito dell’iniziativa “Riparti” promossa dalla Regione Puglia. L’iniziativa è nata per finanziare...
-
Gas serra e cambiamenti climatici, il punto della ricerca
Il messaggio arrivato da Glasgow è chiaro: il processo di riduzione della concentrazione di gas serra in atmosfera dovrà accelerare nei prossimi anni. In questa transizione è di fondamentale importanza poter contare su dati di elevatissima qualità...
-
17 giugno: Giornata Mondiale per la lotta alla desertificazione e alla siccità
L’occasione è la Giornata Mondiale per la lotta alla desertificazione e alla siccità, momento di assoluta rilevanza rispetto alla tematica della scarsità dell’acqua e della corretta gestione delle risorse. A questo proposito, particolare riferimento va prestato al...
-
PNRR, ecco le 6 missioni possibili
Il Governo ha trasmesso al Parlamento il testo del Piano Nazionale di Ripresa e Resilienza (PNRR). Il Piano, come noto, si inserisce all’interno del programma Next Generation EU (NGEU), ovvero il pacchetto da 750 miliardi di euro concordato dall’Unione Europea in risposta alla...